INVESTIGACIÓN
¿Quedamos desprotegidos con la pérdida de anticuerpos de la COVID-19?
Texto: Salvador Iborra. Artículo coordinado por la Unidad de Cultura Científica y de la Innovación - 20 nov 2020 14:08 CET
Los científicos y las autoridades sanitarias han determinado una duración de los anticuerpos que genera nuestro cuerpo cuando supera la COVID-19 de seis meses. Por tanto, aquellos pacientes que se contagiaron en el primer cuarto de año estarían ya experimentando la temida “pérdida” de esos anticuerpos. ¿Quedan esos individuos totalmente desprotegidos frente a una nueva infección? Salvador Iborra, investigador del grupo de Inmunobiología Linfocitaria de la Universidad Complutense de Madrid explica los conceptos de inmunidad y memoria humoral y celular, así como el papel de los linfocitos T y B para prolongar la protección.
Nuestro sistema inmunitario está compuesto por una batería defensiva compleja, diversa, que es capaz de adecuarse al patógeno que nos invade. Esta capacidad de adaptación depende de nuestros linfocitos T y B -células que circulan en la sangre y son parte del sistema inmunitario-.
De la inmunidad humoral…
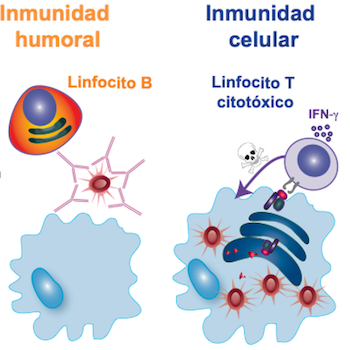
Los linfocitos B, con la ayuda de linfocitos T cooperadores, nos permiten atacar al patógeno cuando se encuentra en el exterior de nuestras células mediante anticuerpos que reconocen su superficie. Este tipo de inmunidad se llama humoral, y en muchas ocasiones es esencial para neutralizar la capacidad infectiva de los virus o de las bacterias.
Pero no siempre es así. Por un lado, algunos patógenos enmascaran su superficie, otros la modifican con frecuencia y algunos incluso se dejan “atrapar” por los anticuerpos, ya que esto les permite entrar en su célula hospedadora, donde pueden sobrevivir y multiplicarse, sin prácticamente exponerse a los “peligros” del exterior celular. Por otro lado, esta inmunidad sólo es eficiente para reconocer los patógenos en el exterior de las células.
 … a la celular
… a la celular
A diferencia de los linfocitos B, los linfocitos T citotóxicos (CD8+) pueden reconocer los patógenos en el interior de una célula infectada, este tipo de inmunidad se llama celular. Para que puedan ser reconocidas por los linfocitos T, las células infectadas pueden exponer en su superficie pequeños fragmentos de las proteínas propias o del virus o bacteria, unidas a los complejos mayores de histocompatibilidad, un conjunto de proteínas que también participan en el rechazo de trasplantes.
Tras el reconocimiento específico de los antígenos del virus, los linfocitos citotóxicos liberan el contenido de sus gránulos, que contienen perforina, una proteína que daña la superficie celular y permite la entrada de otras sustancias tóxicas que inducen la muerte de la célula infectada para su posterior eliminación.
Además, estos linfocitos secretan Interferón gamma, una citocina (una especie de hormona de nuestro sistema inmunitario), que actúa de señal de alerta en el sitio de infección, fomentando que las células infectadas presenten las proteínas del patógeno a nuevos linfocitos y facilitando la eliminación de las células muertas por parte de los macrófagos.
Desaparición de anticuerpos, ¿desprotección total?
Una vez ha sido controlada la infección, algunos linfocitos B sobreviven y pueden seguir secretando anticuerpos, constituyendo una parte de nuestra memoria inmunitaria humoral. A medida que pasa el tiempo, la cantidad de anticuerpos va disminuyendo y a veces resultan indetectables en los test. Sin embargo, esto no significa que el individuo quede completamente desprotegido frente a una futura reinfección.
Al igual que los linfocitos B, una parte de nuestros linfocitos T citotóxicos también sobreviven tras controlar la infección, y constituyen nuestra memoria inmunitaria celular. En el caso del coronavirus del síndrome respiratorio agudo grave (SARS-CoV), que precedió al actual SARS-CoV-2, se han podido detectar linfocitos T citotóxicos contra el virus 6 años después del control de la infección.
Una ventaja de la inmunidad celular es que pueden reconocer proteínas que el patógeno no puede mutar con la misma facilidad que modifica los antígenos de su superficie, ya que cumplen funciones esenciales para el patógeno. Algunos de estos antígenos pueden incluso ser muy similares entre diferentes cepas y especies de virus, lo que permitiría que los mismos linfocitos pudiesen reconocer infecciones causadas por patógenos distintos.
Generar linfocitos citotóxicos con vacunas
En las últimas décadas se ha visto que, aunque gran que parte de estos linfocitos circulan por la sangre y patrullan el bazo y los ganglios linfáticos, una parte importante de los linfocitos T citotóxicos establecen su residencia en el tejido donde se enfrentaron con las células infectadas.
Por ejemplo, ratones vacunados en su piel con el virus de la viruela vacuna (vaccinia), mantienen una población de linfocitos citotóxicos en la piel meses después de que se elimine el virus. Igualmente, tras una infección con el virus de la gripe, una parte de los linfocitos citotóxicos residen por largos periodos de tiempo en el pulmón y en las vías respiratorias altas a la espera de encontrarse de nuevo con células infectadas por el mismo virus.
Estas células de memoria que residen en los tejidos barrera son esenciales para una rápida detección del virus o bacteria y su eliminación. Entre los diversos candidatos a vacunas frente a la COVID-19, algunos están diseñados para generar este tipo de linfocitos citotóxicos de memoria residentes en las vías respiratorias.
* El autor del texto, Salvador Iborra, es investigador del Departamento de Inmunología, Oftalmología y ORL y miembro del grupo Inmunología Linfocitaria de la Universidad Complutense de Madrid